【中文名称】溴
【英文名称】Bromine
【分子式】Br2
【分子量】159.81
【CAS登录号】[7726-95-6]
【物理性质】黑色或红棕色易挥发液体,bp 59oC, mp –7 oC, d 3.128 g/cm3。它溶于水、乙酸、乙醇、乙醚、氯仿、四氯化碳、二硫化碳以及烃类溶剂如正戊烷、石油醚等。
【制备和商品】各试剂公司均有销售。商品试剂为纯溴液体或1.0 mol/L的四氯化碳溶液。
【注意事项】溴不管液体或气体形式都是强腐蚀性和毒性试剂。液溴溅到皮肤上会产生疼痛烧伤和水疱,此时应用水冲洗并用10% 的硫代硫酸钠溶液中和洗涤。在使用液溴时应穿戴保护装备,如实验服、围裙、保护手套以及带NIOSH许可的有机挥发性酸滤罐的防毒面罩。溴必须储存放置于干燥、阴凉之处,严格避免与易燃物、氨水、碱性氢氧化物、金属 (包括铝、汞、镁和钛) 以及部分种类的橡皮、塑料接触。使用时一定要小心谨慎!
--------------------------------------------------------
液溴是一个有效的溴化试剂和氧化试剂,能够引发或参与环化物的开环和重排反应。
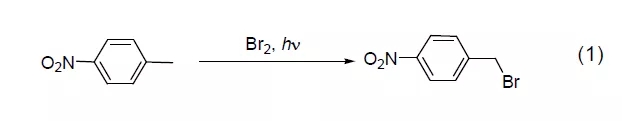
液溴对于许多系统而言都是一个强有力的溴化试剂。虽然对烷烃的溴化反应还存在一定困难,但在光照的自由基反应条件下可以实现芳基烷烃在苄位的溴化反应 (式1)[1]。采用N-溴代丁二酰亚胺(NBS) 作溴化试剂也可以实现该反应。【Wohl–Ziegler反应】
在路易斯酸存在下溴可以对芳烃发生亲电芳基取代反应得到溴代芳烃。由于溴较强的吸电子效应,因此通常亲电取代得到的都是单溴化产物。然而对于高反应活性的芳烃,如苯酚、苯胺和多烷基苯,即使没有路易斯酸催化,通常也得到多溴代产物。
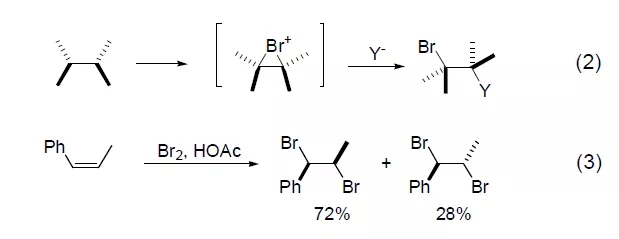
溴对烯烃的加成反应经历了环状溴鎓离子的形成,溴鎓离子被电负性基团Y-亲核进攻,得到反式加成产物 (式2)[2]。溴鎓离子也可以被溴本身进攻,得到反式的二溴化合物。对于不对称的烯烃在形成溴鎓离子时,由于键的强弱不同,反应会立体选择性得到某种溴化产物 (式3)[3],并且很容易发生重排反应。冠醚和沸石的存在通常可以提高烯烃溴化反应的选择性。共轭二烯主要生成1,4-二溴产物,而炔烃则不太容易发生亲电进攻。
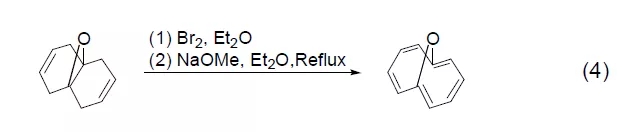
溴对烯烃的加成反应还可以作为氧化烯烃至1,3-丁二烯的第一步反应 (式4)[4]。也可以通过溴化反应来保护或纯化烯烃,然后再消除重新得到烯烃。
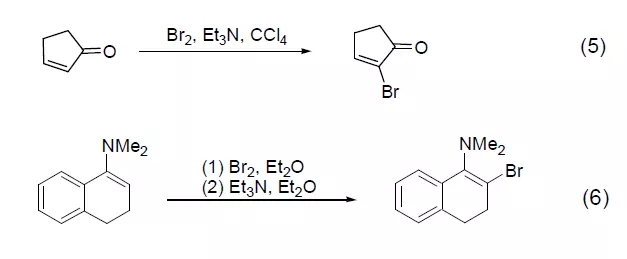
对于一端带吸电子取代基的烯烃如α,β-不饱和环戊酮的溴化反应,通常会经过溴化/脱溴反应选择性得到α-溴化产物 (式5)[5]。而对于一端带给电子取代基的底物,如烯醇醚、烯胺的溴化反应,则能选择性得到β-溴化产物(式6)[6]。
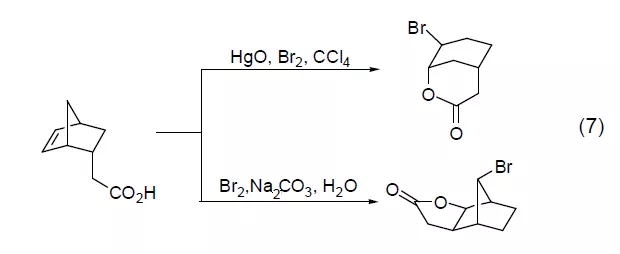
烯酸的溴内酯化反应是烯烃溴化反应的一个扩展。通常在羧酸盐存在下进行的溴内酯化反应都会发生产物的重排,只有在Hg(II) 盐和溴共同作用下才能得到正常的溴内酯化反应 (式7)[7]。采用其它亲电性溴源如NBS则生成其它产物。
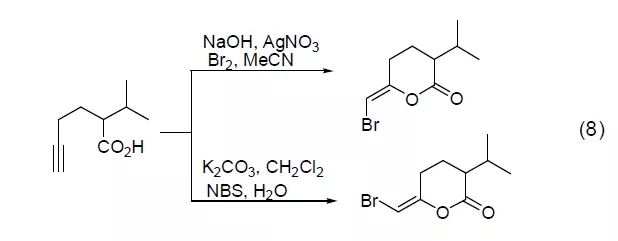
炔酸在溴作用下会发生烯醇内酯化反应,在不同的金属盐诱导和不同的溴源作用下能得到不同的溴代烯醇异构体 (式8)[8]。
烯基酰胺化合物通常在溴作用下会环化得到内酰胺化合物。但当氨基氮上带取代基时,能发生溴代内酰胺化反应 (式9)[9]。这是由于氮上取代基的引入会降低底物的水解常数,从而抑止了底物的水解。
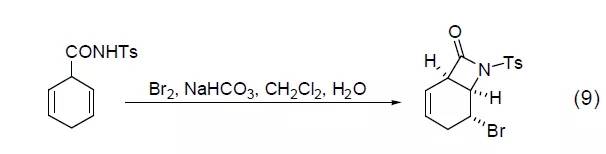
溴还可以用于有机金属试剂的溴化反应,如有机镁、有机锂和有机铝都能同溴反应得到金属被溴取代的产物。有机硼试剂能与溴以多种方式反应,在甲醇钠存在下生成相应的烷基溴化物,还可发生光溴化反应首先得到α-溴化有机硼,进而得到烷基溴化物或重排得到新的有机硼试剂。有机硼在溴作用下也可发生构象翻转,如硼酸酯与溴反应得到构象翻转的溴化产物 (式10)[10]。
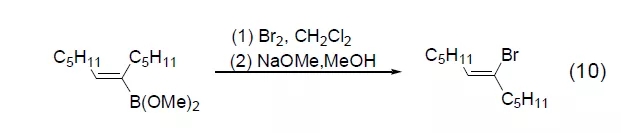
溴参与的另一类重要反应是氧化反应,如将二级醇氧化为酮 (式11)。该反应的一个特点在于底物内酯不存在α-H,因此不会发生α-溴化反应。一级醇在溴作用下可以被氧化为醛或者酯,其中一个有趣的反应是溴将缩醛氧化为酯的反应 (式12)[11]。
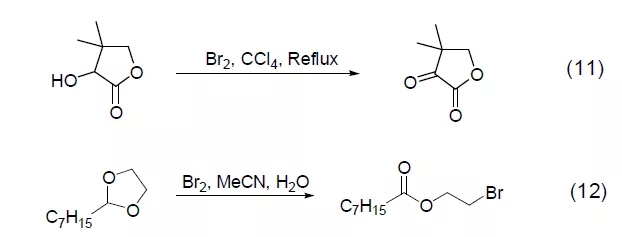
与其它试剂组合成的共氧化试剂能显示出特异的氧化性,如Br2/HMPA、Br2/HBD 能选择性地对二级醇发生作用 (式13)[12],而Br2/羧酸镍的组合则能通过选择性的氧化一级醇将1,4-二醇转换为γ-丁内酯 (式14)[13]。
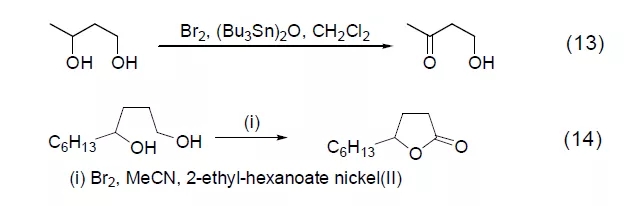
溴能与许多官能团反应导致键的断裂或骨架重排。在经典的Hofmann 反应中,依据不同的反应条件,一级酰胺能与溴在碱存在下反应得到异氰酸酯、氨基甲酸酯或酰胺 (式15)。【Hofmann重排, Hofmann 降解制备胺】
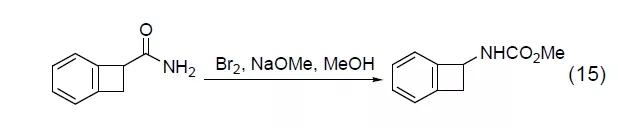
三元环对溴非常敏感。环丙烷在溴作用下会开环得到1,3-二溴丙烷,而环丙烯乙醇在溴作用下则发生重排得到3-亚甲基四氢呋喃 (式16)[14]。三甲基硅环丙酯在溴作用下会开环得到β-溴化酮 (式17)。
参 考 文 献
1. (a) Woods, G. B. Chem. Rev., 2003, 12, 14. (b) Thaler, W. J.Am. Chem. Soc., 1963, 85, 2607. (c) Brewster, J. F. J. Am.Chem. Soc., 1918, 40, 406.
2. (a) Carey, F. A.; Sundberg, R. J. Advanced Organic Chemistry, 2nd ed.; Plenum: New York, 1984. (b) PreparativeOrganic Chemistry, Hilgetag, G.; Martini, A. Eds., Wiley:New York, 1972.
3. (a) Rolston, J. H.; Yates, K. J. Am. Chem. Soc., 1969, 91,1469. (b) Rolston, J. H.; Yates, K. J. Am. Chem. Soc., 1969,91, 1477.
4. Corey, E. J.;Myers, A. G. J. Am. Chem. Soc., 1985, 107, 5574.
5. Guaciaro, M. A.; Wovkulich, P. M.; Smith, A. B. TetrahedronLett., 1978, 4661.
6. Lau, K. S. Y.; Schlosser, M. J. Org. Chem., 1978, 43, 1595.
7. Coery, E. J.; Hase, T. Tetrahedron Lett., 1979, 355.
8. Dai, W.; Katzenellenbogen, J. A. J. Org. Chem., 1991, 56,6893.
9. (a) Biloski, A. J.; Wood, R. D.; Ganem, B. J. Am. Chem. Soc.,1982, 104, 3233. (b) Rajendra, G.; Miller, M. J. TetrahedronLett., 1985, 5385. (c) Rajendra, G.; Miller, M. J. J. Org.Chem., 1987, 52, 4471.
10. Brown, H. C.; Bhat, N. G. Tetrahedron Lett., 1988, 21.
11. Ueno, Y.; Okawara, M. Tetrahedron Lett., 1976, 4597.
12. Doyle, M. P.; Bagheri, V. J. Org. Chem., 1981, 46, 4806.
13. Al-Dulayymi, J. R.; Baird, M. S. Tetrahedron, 1990, 46,5703.
14. Murai, S.; Seki, Y.; Sonoda, N. Chem. Commun., 1974,1032.
关键词:溴
分享至:
![]()
![]()




鄂公网安备 42011102004299号
© 2014-2024 前衍化学科技(武汉)有限公司 版权所有 鄂ICP备20009754号-1