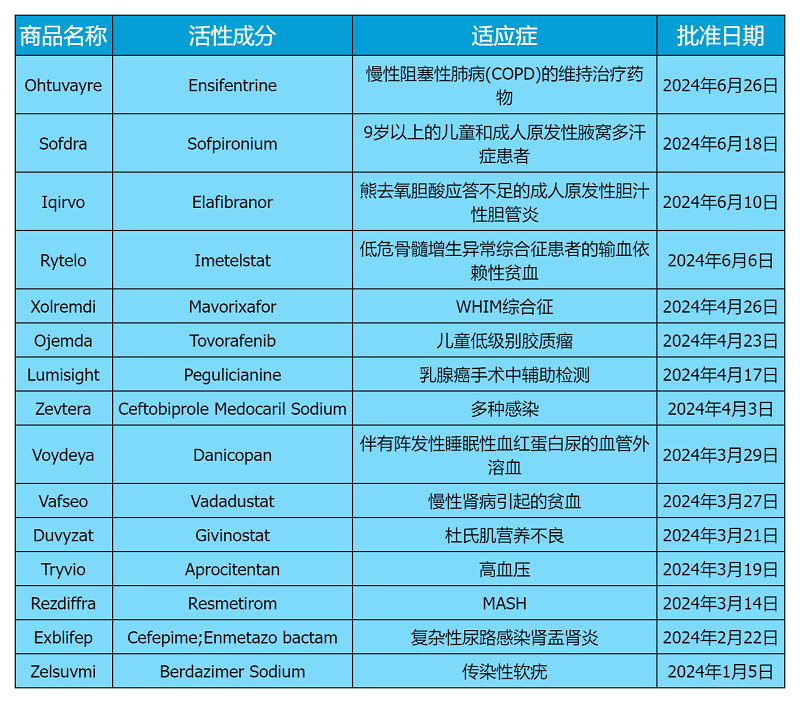
2024年上半年CDER批准了21个新分子实体,其中15种为化学合成药物,6种为生物制剂。
值得注意的是,与去年同期相比,今年上半年获批的新药数量显著减少,2023年同期已有26种新分子药物获得批准。
2024上半年,CDER批准的化药新药
在审批流程中,15种新化学药物中有8种药物是通过优先审评获批上市的,相较于常规审批流程需要10个月,优先审评要求在6个月内完成,这些药物通常因其较高的治疗价值而获得优先考虑。
从适应症角度分析,5种药物针对代谢性疾病,3种针对肿瘤,免疫治疗、抗感染以及其他类别各有2种,神经系统疾病有1种。在这些新化学药物中,孤儿药有6种,占比接近一半,这反映出罕见病治疗领域的研发热情依然高涨。
接下来,根据公开的资料,简要概述一些新近获批的新化学药品。
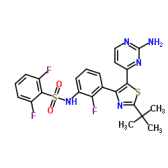
Iqirvo(Elafibranor)
6月10日,益普生公司宣布,美国食品药品监督管理局(FDA)已迅速批准了Iqirvo的上市申请。Iqirvo是一种首创的口服PPAR激动剂,每日服用一次,适用于治疗那些对UDCA反应不佳的成人原发性胆汁性胆管炎(PBC)患者,或者作为单一治疗方案,用于治疗那些对UDCA不耐受的患者。PBC是一种罕见的肝脏疾病,在美国大约影响10万人,有可能导致肝功能衰竭。
这是近十年来首个获得批准用于治疗罕见肝病原发性胆汁性胆管炎的新药。
Iqirvo的快速批准是基于《新英格兰医学杂志》上发表的III期ELATIVE临床试验结果。值得一提的是,同一靶点的药物Seladelpar,也已被FDA纳入优先审评程序,预计将在8月宣布其审评结果。
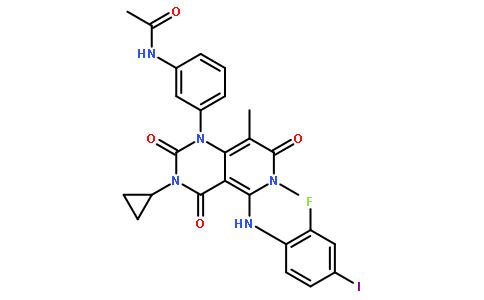
Ojemda(Tovorafenib)
4月23日,FDA快速批准了Day One Biopharmaceuticals研发的广谱RAF激酶抑制剂Ojemda(tovorafenib),用于治疗6个月以上患有复发性或难治性儿童低级别胶质瘤(pLGG)的患者,特别是那些携带BRAF基因融合、重排或V600突变的患者。儿科低级别胶质瘤是儿童中最常见的脑瘤,根据统计,美国儿童每年每十万人中有1.3至2.1例新发病例,预计每年新增1000至1600例。2023年3月16日,FDA已经批准了诺华公司的BRAF/MEK联合疗法,包括Tafinlar(dabrafenib,达拉非尼)和Mekinist(trametinib,曲美替尼)。
这是pLGG的首个靶向疗法。
Tovorafenib是一种口服的、能够穿透血脑屏障的、选择性广谱Raf抑制剂,用于针对 MAPK 信号通路中的关键酶,以治疗儿童复发性或难治性低级别胶质瘤。Ojemda作为一种全身性治疗手段,能有效阻止携带BRAF基因融合或V600突变的肿瘤细胞增殖,并且具备穿透大脑的能力。该药物之前因其在FIREFLY-1临床2期试验中的表现,被FDA认定为突破性疗法,并获得了罕见儿科疾病治疗资格。
Xolremdi(Mavorixafor)
4月26日,X4 Pharmaceuticals公司宣布,FDA已批准Xolremdi(mavorixafor)胶囊上市,用于治疗12岁及以上的WHIM综合征患者,目的是提升血液中成熟中性粒细胞和淋巴细胞的水平。WHIM综合征是一种罕见的原发性免疫缺陷病,伴随慢性中性粒细胞减少,其名称来源于其主要症状:疣,低丙种球蛋白血症,感染和骨髓细胞增多症。
这是首款获批针对WHIM综合征患者的小分子疗法。
Mavorixafor作为CXC趋化因子受体4(CXCR4)的口服可用拮抗剂,在III期4WHIM临床试验中显示出显著效果,与安慰剂组相比,使用Xolremdi的患者年感染率显著下降60%,年感染次数降至不足一次,而安慰剂组则高达4.5次。随着治疗的持续,感染率的降低效果更为显著。
Duvyzat(Givinostat)
3月21日,FDA批准Italfarmaco/ITF的口服药物Duvyzat(givinostat),该药用于治疗六岁及以上的杜氏肌营养不良症(DMD)患者。Givinostat作为组蛋白去乙酰化酶(HDAC)的抑制剂,其作用机制是通过靶向致病过程,以减轻炎症反应和肌肉组织的损伤。
这是第一个被批准用于治疗所有 DMD 基因变异患者的非甾体药物。
Duvyzat的批准基于一项III期临床研究的成功,该研究不仅实现了从基线到72周的四级爬升评估的主要目标,还在多个关键的次要评价标准上呈现出积极的结果。
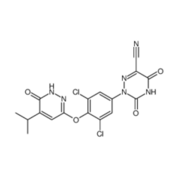
Rezdiffra(Resmetirom)
3月14日,代谢功能障碍相关脂肪性肝炎(MASH)治疗领域取得了重大进展,FDA批准了Madrigal公司研发的Rezdiffra口服小分子药物,用于治疗存在中度至重度肝纤维化的成人患者,该药物需与健康饮食和规律运动相结合使用。
这是40年来首款获批上市的MASH药物。
Resmetirom作为甲状腺激素受体-β (THR-β) 的一种可口服选择性激活剂。在III期MAESTRO-NASH临床试验中展现了显著效果,25.9%接受80 mg剂量和29.9%接受100 mg剂量的患者在治疗后MASH症状得到缓解,且未观察到肝纤维化的进一步恶化。
今年上半年,抗肿瘤、自身免疫疾病、代谢疾病、抗感染和罕见病仍然是FDA批准新药的热点领域。未来的下半年突破还在继续,FDA又会批准哪些新药呢,让我们期待吧!
前衍可提供的实验用小分子化合物



![]()
![]()



